Rotation mudrer billedet
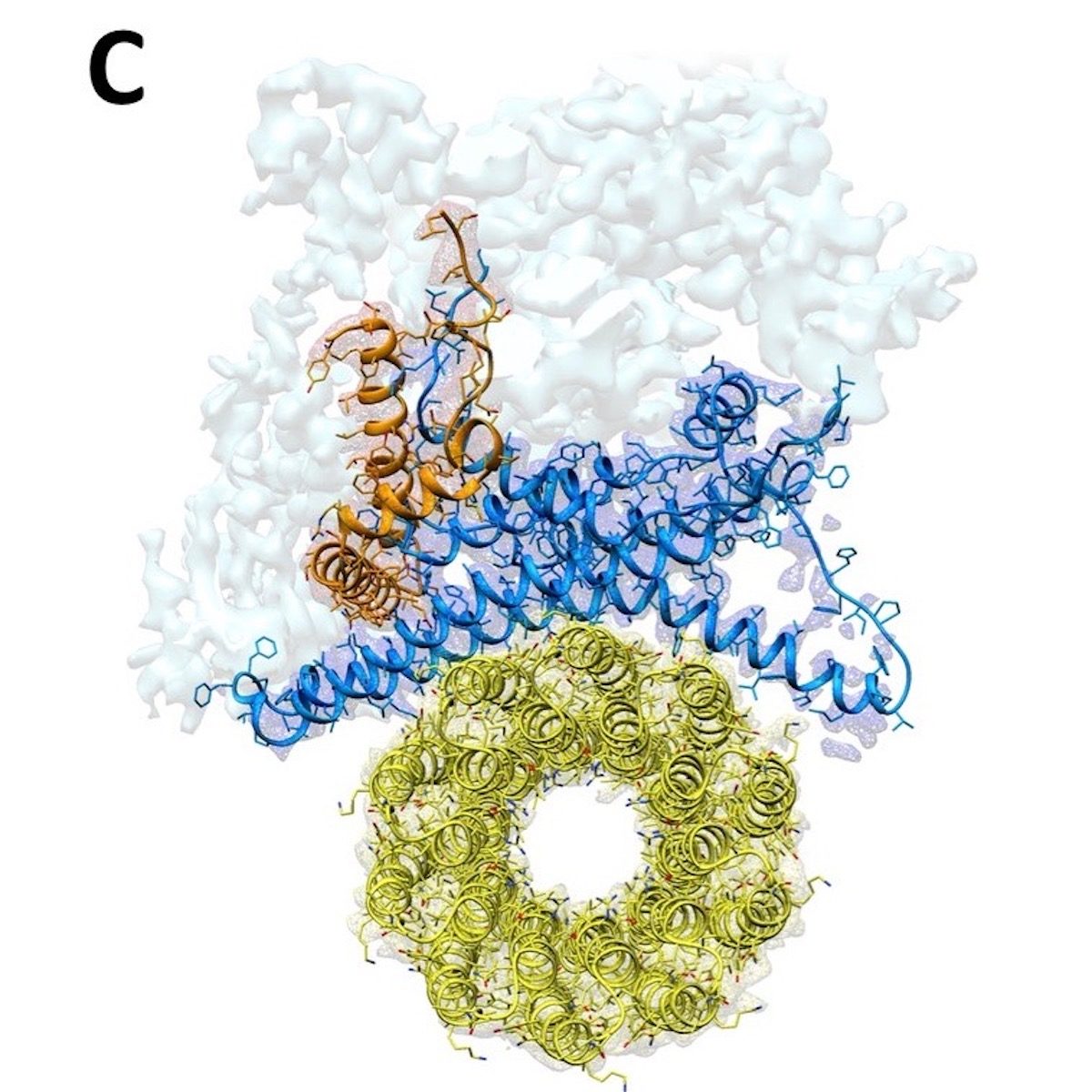
Da strukturen i det svampelignende F1-opløselige domæne allerede er kendt, så Sazanov og hans team især på Fo-domænet, indlejret i mitokondrie-membranen. Her translokeres protoner ved grænsefladen mellem den såkaldte c-ring, en ring, der består af identiske proteinunderenheder, og resten af Fo. Protoner bevæges over membranen, da hver c-underenhed opfanger en proton på den ene side af membranen, roterer med ringen og frigiver protonen på den anden side. Denne c-ring er fastgjort til den centrale aksel på F1, og dens rotation genererer ATP inden for F1. For at løse strukturen i Fo-domænet og hele komplekset undersøgte forskerne enzymet fra fåremitokondrier ved hjælp af kryo-elektronmikroskopi. Og her udgør ATP-syntase et særligt problem: fordi det roterer, kan ATP-syntase stoppe i tre hovedpositioner såvel som i understationer. 'Det er meget vanskeligt at skelne mellem disse positioner ved at tildele en struktur til hver position, ATP-syntase kan indtage. Men det lykkedes os at løse dette beregningsmæssigt for at opbygge den første komplette struktur af enzymet, 'tilføjer Sazanov.
Kommentar: Delvist oversat af Sott.net fra Structure of ATPase, the world's smallest turbine, solved
Location of the permeability transition pore found
In their high-resolution structure of Fo, the researchers found that the c-ring is plugged by two lipids, one from each side of the membrane. While the top (facing F1) lipid rotates along with the shaft, the bottom lipid does not rotate, as it is likely connected to the Fo domain via a "hook apparatus."
This newly uncovered structure sheds light on a controversy in biology: how and where the so-called permeability transition pore opens. This pore is linked with cell death, and opens for example during strokes and heart attacks. So far, it was known that the pore forms in mitochondria in response to high levels of Calcium, but the pore's exact location remained unknown. Now, using the fully solved structure of F1Fo, Sazanov and his group can describe how the pore forms in F1Fo-ATP synthase: When Calcium binds in the F1 subunit, a large conformational change is induced. The complex has to accommodate this change, and in doing so, pulls on the hook apparatus. The apparatus in turn pulls out the lipid plug on the bottom side of the Fo, initiating pore opening. "When the pore is open for a longer period of time, the c-ring is destabilized and pore formation becomes irreversible," explains Sazanov. "This model is consistent with all available data from mutants. To be fully sure that this is how the permeability transition pore forms, one would need to solve the structure of ATP synthase during Calcium-induced transitions, which we are doing now."



Kommentar: Nothing to see here. Completely random, no hint of intelligence in its design.